Lý thuyết liên kết cộng hóa trị phân cực, liên kết cộng hóa trị, trắc nghiệm hóa học lớp 10
Trong kiến thức môn hóa học, liên kết cộng hóa trị là một kiến thức cơ bản vô cùng quan trọng mà các bạn học cần nắm vững. Bài viết dưới đây sẽ giúp bạn đọc hiểu rõ được liên kết cộng hóa trị là gì và những kiến thức liên quan đến liên kết cộng hóa trị. Cùng tìm hiểu với chúng tôi nhé!
Hóa trị là gì?
Trước khi tìm hiểu liên kết cộng hóa trị là gì? Chúng ta cùng tìm hiểu hóa trị là gì nhé.
Hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác. Hóa trị của một nguyên tố được xác định theo hóa trị của H chọn làm đơn vị (H hóa trị I) và hóa trị của O là hai đơn vị (O hóa trị II). Hóa trị của một nhóm nguyên tố cũng tương tự như trên (nhóm nguyên tử được coi như một nguyên tố bất kỳ).
Có những nguyên tố chỉ thể hiện một hóa trị nhưng cũng có những nguyên tố có một vài hóa trị khác nhau.
Liên kết cộng hóa trị là gì?
Từ những phân tích ở trên chúng ta cùng xem liên kết cộng hóa trị là gì.
Xét về lịch sử, liên kết cộng hóa trị được ra đời năm 1939. Đây là năm thuật ngữ này được sử dụng lần đầu tiên. Tuy nhiên, Irving Langmuir đã đưa thuật ngữ này vào năm 1919 với mục đích mô tả các cặp electron được chia sẻ bởi các nguyên tử lân cận.
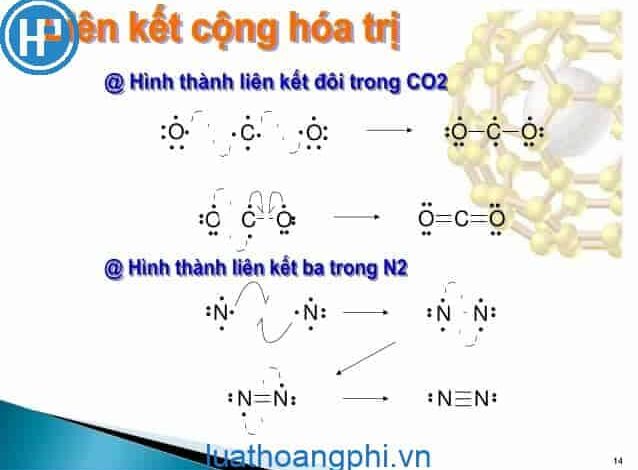
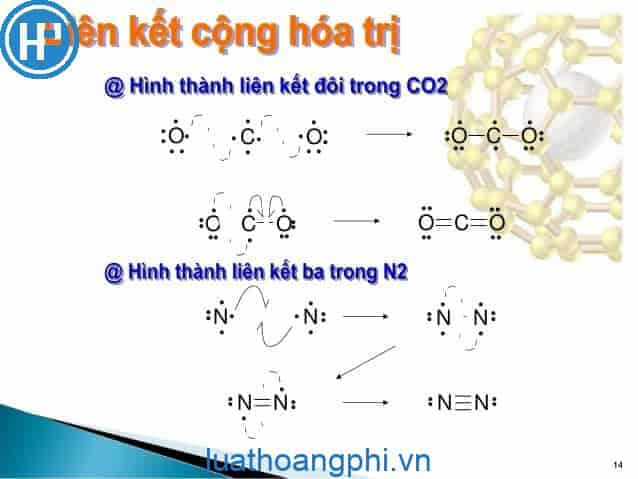
Đến ngày nay, liên kết cộng hóa trị hiểu là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung. Mỗi cặp electron chung tạo nên một liên kết cộng hóa trị, nên ta có liên kết đơn (trong phân tử H2), có liên kết ba (trong phân tử N2).
Liên kết cộng hóa trị còn gọi là liên kết phân tử. Với nhiều phân tử, việc dùng chung electron cho phép mỗi nguyên tử đạt được cấu hình electron bền vững.
Như vậy, chúng tôi đã giúp cho bạn đọc hiểu được liên kết cộng hóa trị là gì rồi.
Các loại liên kết cộng hóa trị
Có tất cả 5 loại cộng hóa trị, cụ thể đó là:
Liên kết cộng hóa trị có cực
Một liên kết cộng hóa trị có cực sẽ được tạo ra khi các electron dùng chung giữa các nguyên tử không được chia sẻ như nhau. Điều này chỉ xảy ra khi một nguyên tử có độ âm điện cao hơn nguyên tử mà nó đang chia sẻ.
Nguyên tử có độ âm điện cao hơn sẽ có lực hút mạnh hơn so với với các điện tử. Chính vì vậy, các electron được chia sẻ sẽ ở gần nguyên tử hơn với độ âm điện cao hơn, khiến nó chia sẻ không được đồng đều.
Một liên kết cộng phân tử có cực sẽ dẫn đến phân tử nghiêng về phía chứa nguyên tử có độ âm điện thấp hơn. Về phía hơi âm chứa nguyên tử có độ âm điện cao hơn vì các electron dùng chung sẽ bị dịch chuyển về phía nguyên tử có độ âm điện càng cao.
Kết quả của liên kết cộng hóa trị có cực, hợp chất của cộng hóa trị hình thành sẽ có một thế tĩnh điện.
Một ví dụ điển hình về các phân tử hình thành liên kết yếu với nhau là kết quả của thế tĩnh điện không cân bằng là liên kết của hidro. Trong đó một nguyên tử hydro sẽ tương tác với một nguyên tử Flo, Hidro hoặc nguyên tử oxi từ một phân tử hoặc nhóm hóa học khác.
Liên kết hóa trị không cực
Một liên kết hóa trị không cực được tạo ra khi những nguyên tử chia sẻ các electron bằng nhau. Điều này thường xảy ra khi hai nguyên tử có lực tương tự hoặc có cùng điện tử.
Các giá trị của lực điện tử của chúng càng gần thì sức hút của chúng càng mạnh. Điều này xảy ra trong những phân tử khí, còn được gọi là các yếu tố diatomic. Liên kết phân tử không cực có khái niệm tương tự với liên kết phân tử có cực. Nguyên tử có độ âm điện cao hơn sẽ hút electron ra khỏi hạt yếu hơn.
Liên kết đơn phân tử
Một liên kết đơn phân tử là khi 2 phân tử đều chia sẻ 1 cặp electron duy nhất. Mặc dù ở dạng liên kết này yếu hơn và có mật độ nhỏ hơn liên kết đôi và liên kết ba. Tuy nhiên nó lại ổn định nhất vì nó có mức độ phản ứng thấp hơn đồng nghĩa với việc ít bị ảnh hưởng hơn khi bị mất electron trước các nguyên tử muốn đánh cắp electron.
Ví dụ: Liên kết phân tử giữa nguyên tử H2 và Cl2 sẽ tạo nên axit HCl.
Liên kết đôi phân tử
Liên kết đôi là khi hai nguyên tử chia sẻ hai cặp electron cho nhau. Nó được mô tả bằng hai đường ngang giữa hai nguyên tử trong một phân tử. Loại liên kết này mạnh hơn rất nhiều so với liên kết đơn, nhưng nó lại kém ổn định hơn.
Ví dụ : Khí CO2. Carbon dioxide có tổng cộng gồm 1 nguyên tử Cacbon và 2 nguyên tử Oxy. Mỗi nguyên tử Oxi có 6 electron hóa trị trong khi nguyên tử Cacbon chỉ có 4 electron hóa trị. Để đáp ứng đúng quy tắc Octet, nguyên tử Cacbon cần thêm 4 electron hóa trị. Vì mỗi nguyên tử Oxi sẽ có 3 cặp electron đơn độc, mỗi cặp có thể chia sẻ 1 cặp electron với Carbon.
Liên kết 3 phân tử
Liên kết ba là khi ba cặp electron được chia sẻ giữa hai nguyên tử trong cùng một phân tử. Đây là loại kém ổn định nhất trong các loại liên kết cộng hóa trị.
Ví dụ: C2H2. Acetylene gồm tổng cộng 2 nguyên tử Cacbon và 2 nguyên tử Hidro. Mỗi nguyên tử Hidro sẽ có 1 electron hóa trị, trong khi mỗi nguyên tử Cacbon có 4 electron hóa trị. Mỗi Cacbon phải cần thêm 4 electron và mỗi Hidro cần thêm 1 electron. Hidro chia sẻ electron duy nhất của nó cho Carbon để có được hóa trị đầy đủ. Bây giờ nguyên tố Carbon có 5 electron.
Bởi vì mỗi nguyên tử Cacbon gồm có 5 electron – 1 liên kết đơn và 3 electron chưa ghép cặp – hai Carbons có thể chia sẻ các electron chưa ghép cặp của chúng để tạo thành liên kết ba.
Tính chất của liên kết cộng hóa trị
Vậy tính chất của liên kết cộng hóa trị là gì? Qua các nghiên cứu, liên kết cộng hóa trị có những tính chất sau:
– Liên kết cộng hóa trị không dẫn đến sự hình thành của các electron mới. Mối liên kết chỉ có thể trao đổi electron với nhau. Chúng là những liên kết hóa học rất mạnh tồn tại giữa nhiều nguyên tử.
– Mỗi một liên kết cộng hóa trị thường chứa năng lượng khoảng 80 kilocalories/ mol (kcal/mol).
– Liên kết cộng hóa trị rất hiếm khi bị phá vỡ một cách tự nhiên sau khi nó được hình thành. Hầu hết những hợp chất có liên kết cộng hóa trị có điểm nóng chảy và điểm sôi tương đối thấp.
– Những hợp chất có liên kết cộng hóa trị thường có entanpi hóa hơi và nhiệt hạch thấp hơn. Các hợp chất được tạo thành bằng liên kết cộng hóa trị không dẫn điện vì thiếu các điện tử tự do. Các hợp chất cộng hóa trị không tan được trong nước.
Sự khác nhau giữa liên kết cộng hóa trị không cực, có cực và liên kết ion
Sau đây, cùng tìm hiểu sự khác nhau giữa liên kết cộng hóa trị không cực, có cực và liên kết ion nhé!
Thứ nhất : Về sự hình thành liên kết
– Liên kết cộng hóa trị không cực: Cặp e ở giữa 2 nguyên tử;
– Liên kết cộng hóa trị có cực: Cặp e chung nằm phía nguyên tử có độ âm điện lớn hơn;
– Liên kết ion: Nguyên tử kim loại nhường e, nguyên tử phi kim nhận e.
Thứ hai: Về điều kiện liên kết
– Liên kết cộng hóa trị không cực: Giữa 2 phi kim giống hệt nhau;
– Liên kết cộng hóa trị có cực: Giữa 2 phi kim giống hệt nhau;
– Liên kết ion: Giữa kim loại điển hình và phi kim điển hình.
Một số ví dụ liên kết cộng hóa trị
Các chất mà phân tử chỉ có liên kết cộng hóa trị có thể là chất rắn như đường, lưu huỳnh, iot,…, có thể là chất lỏng: nước, ancol,… hoặc chất khí như khí cacbonic, clo, hiđro,… Các chất có cực như ancol etylic, đường,… tan nhiều trong dung môi có cực như nước.
Phần lớn các chất không cực như iot, các chất hữu cơ không cực tan trong dung môi không cực như benzen, cacbon tetraclorua,…
Nói chung, các chất chỉ có liên kết cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
Một số bài tập thường gặp liên quan đến liên kết cộng hóa trị như:
Ví dụ: Cho X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8
1. Viết cấu hình electron nguyên tử của các nguyên tố.
2. Dự đoán liên kết hóa học có thể có giữa các cặp X và A; A và Z; Z và X
Hướng dẫn ví dụ này như sau:
1. Viết cấu hình electron nguyên tử của các nguyên tố:
9X: 1s22s22p5: Là nguyên tố F có độ âm điện là 3,98 (tra bảng độ âm điện)
19A: 1s22s22p63s23p64s1: Là nguyên tố K có độ âm điện là 0,82
9Z: 1s22s22p4: Là nguyên tố O có độ âm điện là 3,44
2. Dự đoán liên kết hóa học có thể có giữa các cặp là:
Cặp A và X, hiệu số âm điện là 3,98 – 0,82 = 3,16 : Liên kết ion
Cặp A và Z, hiệu số âm điện là 3,44 – 0,82 = 2,62 : Liên kết ion
Cặp X và Z, hiệu số âm điện là 3,98 – 3,44 = 0,54 : Liên kết cộng hóa trị có cực
Hy vọng bài viết về liên kết cộng hóa trị là gì? ở trên là nguồn tư liệu quý giá cho Quý bạn đọc. Nếu còn thắc mắc vui lòng liên hệ với chúng tôi để được hỗ trợ nhanh chóng
Liên kết cộng hóa trị – Bài 13 – Hóa học 10 – Cô Phạm Thu Huyền (HAY NHẤT)



