Nguyên tử khối của kali (k)? kali (k) hóa trị mấy?
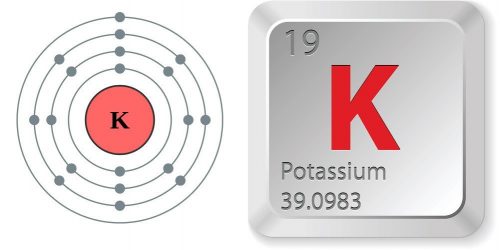
Kali là nguyên tố hóa học được ký hiệu là : K. Kali là kim loại kiềm có tính ứng dụng và rất cần thiết đối với con người. Để biết Nguyên tử khổi của Kali và Kali hóa trị mấy? Các bạn có thể xem chi tiết Kali là gì? Để giải phương trình hóa học chính xác.
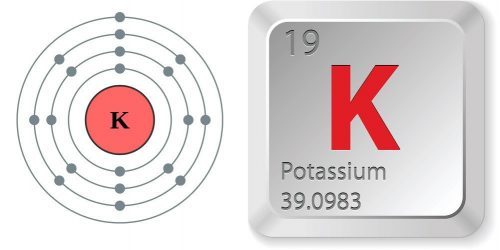
Định nghĩa Kali là gì?
Kali là một sắt kẽm kim loại kiềm được phát hiện bởi Sir Humphry Davy năm 1807, ông tách nó ra từ dung dịch KOH. Kim loại kiềm này là sắt kẽm kim loại tiên phong được điều chế bằng điện phân .
Với khối lượng riêng nhỏ hơn của nước, kali là sắt kẽm kim loại nhẹ thứ hai sau liti. Nó là một chất rắn rất mềm, thuận tiện cắt bằng dao và có màu trắng bạc khi mặt phẳng sạch. Nó bị ôxi hóa rất nhanh trong không khí và phải được dữ gìn và bảo vệ trong dầu mỏ hay dầu lửa .
- Kali bị ôxi hóa rất nhanh trong không khí và phải được bảo quản trong dầu mỏ hay dầu lửa.
- K có khối lượng riêng là 0,863 g/cm3; có nhiệt độ nóng chảy là 63,51ºC và sôi ở 760ºC.
nguyên tử khối của kali (K)? Kali (K) hóa trị mấy?
– Kali kí hiệu là: K
– Kali vị trí trong bảng tuần hoàn
+ Số proton : 19
+ Nhóm : IA
+ Chu kì : 4
+ Kali hóa trị : I
+ Nguyên tử khối Kali : 39
– Cấu hình electron : [ Ar ] 4 s1
– Số hiệu nguyên tử K : 19
– Khối lượng nguyên tử : 39 g / mol
– Đồng vị K : 39K, 40K, 41K .
– Độ âm điện K : 0,82
Tính chất hóa học của Kali
Kali là sắt kẽm kim loại kiềm có tính khử rất mạnh .
K → K+ + 1e
a) K tác dụng với phi kim
4K + O2 → 2K2 O
2K + Cl2 → 2KC l
– Khi đốt trong không khí hay trong oxi, kali cháy tạo thành những oxit ( oxit thường, peoxit và supeoxit ) và cho ngọn lửa có màu tím hoa cà đặc trưng .
b) K tác dụng với axit
Xem thêm: Gia công mô hình composite uy tín chất lượng
– Kali thuận tiện khử ion H + ( hay H3O + ) trong dung dịch axit loãng ( HCl, H2SO4 loãng … ) thành hidro tự do .
2K + 2HC l → 2KC l + H2 .
c) K tác dụng với nước
– K công dụng mãnh liệt với nước và tự phát cháy tạo thành dung dịch kiềm và giải phóng khí hidro .
2K + 2H2 O → 2KOH + H2 .
d) K tác dụng với hidro
– Kali tính năng với hidro ở áp suất khá lớn và nhiệt độ khoảng chừng 350 – 400 oC tạo thành kali hidrua .
2K ( lỏng ) + H2 ( khí ) → 2KH ( rắn )
CÁCH NHỚ NGUYÊN TỬ KHỐI ĐẾN GIÀ | Lê Đăng Khương
CÁCH NHỚ NGUYÊN TỬ KHỐI ĐẾN GIÀ | Lê Đăng Khương
Hai ba Natri (Na=23)
Nhớ ghi cho rõ
Kali chẳng khó
Ba chín dễ dàng (K=39)
Khi nhắc đến Vàng
Một trăm chín bảy (Au=197)
Oxi gây cháy
Chỉ mười sáu thôi (O=16)
Còn Bạc dễ rồi
Một trăm lẻ tám (Ag =108)
Sắt màu trắng xám
Năm sáu có gì (Fe=56)
Nghĩ tới Beri
Nhớ ngay là chín (Be=9)
Gấp ba lần chín
Là của anh Nhôm (Al=27)
Còn của Crôm
Là năm hai đó (Cr=52)
Của Đồng đã rõ
Là sáu mươi tư (Cu =64)
Photpho không dư
Là ba mươi mốt (P=31)
Hai trăm lẻ một
Là của Thủy Ngân (Hg=201)
Chẳng phải ngại ngần
Nitơ mười bốn (N=14)
Hai lần mười bốn
Silic phi kim (Si=28)
Can xi dễ tìm
Bốn mươi vừa chẵn (Ca=40) Mangan vừa vặn
Con số năm lăm (Mn=55)
Ba lăm phẩy năm
Clo chất khí (Cl=35.5)
Phải nhớ cho kỹ
Kẽm là sáu lăm (Zn=65)
Lưu huỳnh chơi khăm
Ba hai đã rõ (S=32)
Chẳng có gì khó
Cacbon mười hai (C=12)
Bari hơi dài
Một trăm ba bảy (Ba=137)
Phát nổ khi cháy
Cẩn thận vẫn hơn
Khối lượng giản đơn
Hiđrô là một (H=1)
Còn cậu Iốt
Ai hỏi nói ngay
Một trăm hai bảy (I=127)
Nếu hai lẻ bảy
Lại của anh Chì (Pb =207)
Brôm nhớ ghi
Tám mươi đã tỏ (Br = 80)
Nhưng vẫn còn đó
Magiê hai tư (Mg=24)
Chẳng phải chần trừ
Flo mười chín (F=19)
Đây là kênh youtube của thầy Lê Đăng Khương Giảng viên Khoa Hóa Trường ĐHSPHN
▶ Nhận lộ trình học Miễn phí tại đây: http://hocsieutoc.vn/course/1656
▶ Hãy đăng ký ngay: https://goo.gl/UuV4rn để theo dõi và nhận Bài giảng Miễn Phí.
Theo dõi kênh Lê Đăng Khương trên
▶ Facebook: https://www.facebook.com/ThayLeDangKhuong/
▶ Fanpage: https://www.facebook.com/ThayLeDangKhuong/
▶ Blog của thầy: ledangkhuong.com
▶ Group học tập dành cho học sinh 2001: https://bit.ly/2scxj87
▶ Website: hocsieutoc.vn
▶ Nhắn tin cho thầy để được hỗ trợ học tập môn Hóa: https://m.me/ThayLeDangKhuong


