Công thức hóa 11: tổng hợp các công thức hóa học lớp 11 học kì 1 và 2

Tổng hợp lý thuyết các công thức hóa học lớp 11 học kì 1
Kì I lớp 11, nội dung kiến thức các bạn cần nắm vững chính là sự điện li, nito-photpho cũng như cacbon-silic. Do đó, công thức hóa 11 kì I bao gồm các nội dung liên quan đến các phần kiến thức trên.
Quá trình phân li thành các ion khi chất điện li tan trong nước hoặc nóng chảy được biết đến chính là sự điện li. Sự điện li được biểu diễn bằng phương trình điện li. Trong phương trình điện li thì tổng điện tích các cation = tổng điện tích các anion.
Tổng quát:

Độ điện li (anpha) của chất điện li được định nghĩa chính là tỉ số giữa số phân tử phân li thành ion với tổng số phân tử ban đầu.
-
Ta có: 0 ≤ α ≤ 1 Hay
0% ≤ α ≤ 100%
-
Ta thấy chất không điện li tức là không bị phân li: α = 0
-
Chất điện li mạnh thì sự phân li sẽ hoàn toàn, cụ thể: α = 1 hay 100%
-
Chất điện li yếu thì sự phân li là không hoàn toàn, cụ thể: 0 < α < 1
=> Như vậy, trong cùng một nhiệt độ và có cùng nồng độ mol/lít chất điện li càng mạnh thì độ điện li α sẽ càng lớn.

Phân loại chất điện li: Từ độ điện li, ta có 2 loại chất điện li như sau:
-
Chất điện li mạnh
.
-
Chất điện li yếu.
Đối với các chất điện li yếu sẽ xuất hiện cân bằng hoá học. Người ta gọi đó là cân bằng động. Nhìn chung, hằng số điện li thường được áp dụng cho sự phân li yếu.
Nếu chất điện li yếu có công thức \(A_{a}B_{b}\) thì công thức phân li trong dung dịch sẽ như sau:
\(A_{a}B_{b}\, aA^{n+}bB^{m-}\)
Khi đó công thức tính hằng số điện li sẽ được tính như sau:
\(K= [A^{n+}]^{a}.[B^{m+}]^{b}/[A_{a}B_{b}]\)
Trong đó: a.n = b.m
Hằng số phân li của axit và bazơ yếu:
-
Đối với những axit hay bazơ yếu thì sự điện li là không hoàn toàn, phương trình điện li thuận nghịch như sau:
-
Hằng số cân bằng của dung dịch axit yếu:
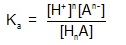
-
Vì K
a
<<1, được viết dưới dạng hàm số mũ âm cơ số 10 rất bất tiện nên người ta chuyển hàm mũ âm thành hàm logarit cơ số 10 với mệnh đề định nghĩa: pK
a
= – logK
a
-
Hằng số cân bằng của dung dịch bazơ yếu:
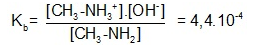
-
Vì K
b
<<1 và được viết dưới dạng hàm mũ âm cơ số 10 nên ta có thể chuyển hàm mũ âm cơ số 10 qua hàm logarit cơ số 10 với định nghĩa pK
b
= -logK
b
Dạng 1: Dung dịch axit yếu HA
\(pH = -\frac{1}{2}(log\, K_{a} + log\, C_{a})\) hoặc \(pH = -log\, \alpha C_{a}\)
Trong đó:
-
\(\alpha\) là độ điện ly
-
\(K_{a}\) là hằng số phân ly của axit
-
\(C_{a}\) là nồng độ mol/l của axit (\(C_{a} \geq 0,01M\))
Dạng 2: Dung dịch đệm (hỗn hợp gồm axit yếu HA và muối NaA)
\(pH = -(log\, K_{a} + log\, \frac{C_{a}}{C_{m}})\)
Dạng 3: Dung dịch bazơ yếu BOH
\(pH = 14 + \frac{1}{2}(log\, K_{b} + log\, C_{b})\)
Với lý thuyết công thức hóa 11, bạn cần nắm vững các công thức phần Nitơ – Photpho như sau:
\(NH_{4}NO_{2} \overset{t^{\circ}}{\rightarrow}N_{2} + 2H_{2}O\)
\(NH_{4}Cl + NaNO_{2} \overset{t^{\circ}}{\rightarrow}N_{2} + NaCl + 2H_{2}O\)
\(NH_{4}^{+} + OH^{-} \rightarrow NH_{3} + H_{2}O\)
\(HNO_{3}\) được biết đến là không bền, cụ thể như khi có ánh sách sẽ phân hủy một phần tạo thành \(NO_{2}\). Lúc này thì công thức phân hủy sẽ như sau:
\(4HNO_{3} \rightarrow 4NO_{2} + O_{2} + 2H_{2}O\)
Tính chất của \(HNO_{3}\) khi tác dụng với kim loại cũng là kiến thức quan trọng trong công thức hóa 11 mà các bạn cần lưu tâm. Ta có hợp chất của Nitơ này có thể oxi hóa hầu hết các kim loại ngoại trừ Au và Pt.
\(M + HNO_{3} \rightarrow M(NO_{3})_{n} + \left\{\begin{matrix} NH_{4}NO_{3}\\ N_{2}\\ N_{2}O\\ NO\\ NO_{2} \end{matrix}\right. + H_{2}O\)
Dạng 1: Kim loại tác dụng với \(HNO_{3}\) dư
a) Tính lượng kim loại tác dụng với \(HNO_{3}\) dư
\(\sum n_{KL}.i_{KL} = \sum n_{spk}.i_{spk}\)
Trong đó:
-
\(i_{KL}\) là hóa trị của kim loại trong muối nitrat
-
\(i_{spk}\) là số e mà \(N^{+5}\) nhận vào
Nếu có Fe tác dụng với \(HNO_{3}\) thì sẽ tạo muối \(Fe^{2+}\), không tạo muối \(Fe^{3+}\).
b) Tính khối lượng muối nitrat thu được khi cho hỗn hợp kim loại tác dụng với \(HNO_{3}\) dư (sản phẩm không có \(NH_{4}NO_{3}\))
Công thức:
\(m_{m} = m_{KL} + 62\sum n_{spk}.i_{spk} = m_{KL} + 62(3n_{NO} + n_{NO_{2}} + 8n_{N_{2}O} + 10n_{N_{2}})\)
c) Tính khối lượng muối nitrat thu được khi cho hỗn hợp sắt và oxit sắt tác dụng với \(HNO_{3}\) dư (sản phẩm không có \(NH_{4}NO_{3}\))
Công thức:
\(m_{m} = \frac{242}{80}(m_{hh} + 8\sum n_{spk}.i_{spk}) = \frac{242}{80} [m_{hh} + 8(3n_{NO} + n_{NO_{2}}+ 8n_{N_{2}O} + 10n_{N_{2}})]\)
-
Công thức tính khối lượng muối thu được khi cho hỗn hợp sắt và các oxit sắt tác dụng với \(HNO_{3}\) loãng dư giải phóng khí NO
\(m_{m} = \frac{242}{80}(m_{hh} + 24n_{NO})\)
-
Công thức tính khối lượng muối thu được khi hòa tan hỗn hợp sắt và các oxit sắt tác dụng với \(HNO_{3}\) loãng dư giải phóng khí \(NO_{2}\)
\(m_{m} = \frac{242}{80}(m_{hh} + 8n_{NO_{2}})\)
d) Tính số mol \(HNO_{3}\) tham gia
\(n_{HNO_{3}} = \sum n_{spk}.(i_{spk} + so\, N_{trong\, spk}) = 4n_{NO} + 2n_{NO_{2}} + 12n_{N_{2}} + 10n_{N_{2}O} + 10n_{NH_{4}NO_{3}}\)
Dạng 2: Tính khối lượng kim loại ban đầu trong bài toán oxi hóa 2 lần
\(R + O_{2} \rightarrow\) hỗn hợp A (R dư và oxit của R) \(\rightarrow R(NO_{3})_{n} + H_{2}O\) + sản phẩm khử
Công thức:
\(m_{R} = \frac{M_{R}}{80}(m_{hh} + 8.\sum n_{spk}.i_{spk}) = \frac{M_{R}}{80} [3n_{NO} + n_{NO_{2}}+ 8n_{N_{2}O} + 10n_{N_{2}})]\)
Công thức tính khối lượng sắt đã dùng ban đầu, biết oxi hóa lượng sắt này bằng oxi được hỗn hợp rắn X. Hòa tan hết X với \(HNO_{3}\) đặc, nóng giải phóng khí \(NO_{2}\)
\(m_{Fe} = \frac{56}{80}(m_{hh}+ 8n_{NO_{2}})\)
Một số công thức hóa học quan trọng của muối \(NH_{4}^{+}\) và \(NO_{3}^{-}\)

Các kiến thức về photpho cũng thường nằm trong đề thi THPT Quốc Gia. Chính vì thế, khi ôn tập công thức hóa 11 bạn không nên bỏ qua phần kiến thức này.
Tính oxi hóa
\(P + KL \overset{t^{\circ}}{\rightarrow}\) Photphua kim loại
Ví dụ:
\(2P + 3Ca \overset{t^{\circ}}{\rightarrow} Ca_{3}P_{2}\)
\(3Na + P\overset{t^{\circ}}{\rightarrow}Na_{3}P\)
Tính khử
-
\(3O_{2} + 4P \rightarrow 2P_{2}O_{3}\)
Ví dụ:
\(3O_{2} + 4P \rightarrow 2P_{2}O_{3}\)
Ví dụ:
\(5HNO_{3} + P \rightarrow H_{2}O + 5NO_{2} + H_{3}PO_{4}\)
\(5H_{2}SO_{4} + 2P \rightarrow 2H_{2}O + 5SO_{2} + 2H_{3}PO_{4}\)
\(H_{3}PO_{4} \overset{OH^{-}}{\rightarrow}H_{2}PO_{4}^{-}\overset{OH^{-}}{\rightarrow}HPO_{4}^{2-}\overset{OH^{-}}{\rightarrow}PO_{4}^{3-}\)
Một số trường hợp phản ứng
-
\(H_{3}PO_{4} + NaOH \rightarrow NaH_{2}PO_{4} + H_{2}O\)
-
\(H_{3}PO_{4} + 2NaOH \rightarrow Na_{2}HPO_{4} + 2H_{2}O\)
-
\(H_{3}PO_{4} + 3NaOH \rightarrow Na_{3}PO_{4} + 3H_{2}O\)
Đặt \(\frac{n_{OH^{-}}}{n_{H_{3}PO_{4}}} = x\)
Nếu:
-
\(x \leq 1 \rightarrow H_{2}PO_{4}^{-}\)
-
\(x = 2 \rightarrow HPO_{4}^{2-}\)
-
\(1 < x < 2 \rightarrow H_{2}PO_{4}^{-}, HPO_{4}^{2-}\)
-
\(2 < x < 3 \rightarrow HPO_{4}^{2-},PO_{4}^{3-}\)
-
\(x \geq 3 \rightarrow PO_{4}^{3-}\)
Phản ứng thủy phân của muối Photphat
\(PO_{4}^{3-} + H_{2}O \leftrightarrow HPO_{4}^{2-} + OH^{-}\)
\(H_{2}PO_{4}^{-} + H_{2}O \leftrightarrow H_{3}O^{+} + HPO_{4}^{2-}\)
Ôn luyện công thức hóa 11 bạn cần nắm chắc kiến thức về phần cacbon – silic dưới đây:
Tính oxi hóa của Cacbon khi tác dụng với:
-
Hidro:
\(C+ 2H_{2} \overset{t^{\circ},xt}{\rightarrow}CH_{4}\)
-
Kim loại:
\(Al + C \overset{t^{\circ}}{\rightarrow}Al_{4}C_{3}\)
Cacbonđioxit (\(CO_{2}\))
Phản ứng với dung dịch kiềm:
\(CO_{2} + OH^{-} \rightarrow HCO_{3}^{–}\)
\(CO_{2} + 2OH^{-} \rightarrow CO_{3}^{2-} + H_{2}O\)
Muối cacbonat
\(CO_{2}\) phản ứng với dung dịch kiềm tạo ra 2 muối \(HCO_{3}^{-}\) và \(CO_{3}^{2-}\).
Một số tính chất của muối \(HCO_{3}^{-}\) và \(CO_{3}^{2-}\)
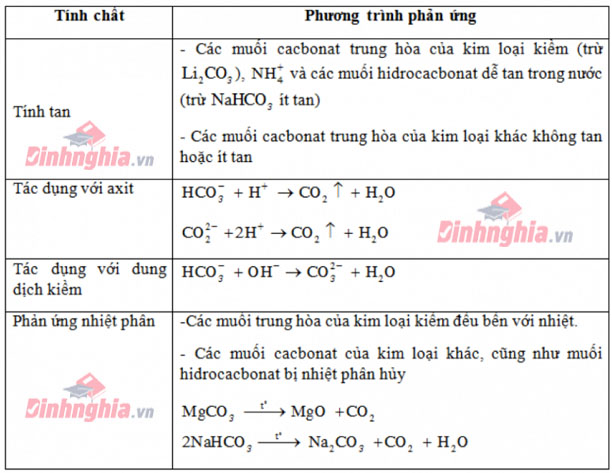
- Dạng 1:
Muối cacbonat + dd HCl \(\rightarrow\) Muối clorua + \(CO_{2} + H_{2}O\)
\(m_{m\, clorua} = m_{m\, cacbonat} + (71-60)n_{CO_{2}}\)
- Dạng 2:
Muối cacbonat + \(H_{2}SO_{4}\) loãng \(\rightarrow\) Muối sunfat + \(CO_{2} + H_{2}O\)
\(m_{m\, sunfat} = m_{m\, cacbonat} + (96-60)n_{CO_{2}}\)
Công thức hóa học về tính khử và tính oxi hóa của silic
Tính khử
\(Si + 2F_{2} \rightarrow SiF_{4}\)
\(Si + O_{2} \rightarrow SiO_{2}\)
\(Si + 2NaOH + H_{2}O \rightarrow Na_{2}SiO_{3} + 2H_{2}\)
Tính oxi hóa
\(2Mg + Si \overset{t^{\circ}}{\rightarrow} Mg_{2}Si\)
Bài tập trắc nghiệm với công thức tính nhanh hóa 11
Số C = \(\frac{n_{CO_{2}}}{n_{A}}\)
Số H = \(\frac{2n_{H_{2}O}}{n_{A}}\)
\(n_{ankan\, (ancol)} = n_{H_{2}O} – n_{CO_{2}}\)
\(n_{ankin} = n_{CO_{2}} – n_{H_{2}O}\)
Lưu ý: A là \(C_{x}H_{y}\) hoặc \(C_{x}H_{y}O_{z}\) mạch hở, khi cháy cho: \(n_{CO_{2}} – n_{H_{2}O} = k.n_{A}\) thì A có số \(\pi = (k+1)\).
Số đồng phân của \(C_{n}H_{2n+2} = 2n-4 + 1\, (3 < n < 7)\)
Số đồng phân của \(C_{n}H_{2n-6} = (n – 6).2\, (6 < n < 10)\)
\(C_{n}H_{2n+2} + X_{2} \rightarrow C_{n}H_{2n+1}X + HX\)
Ankan X \(\rightarrow\) Hỗn hợp Y ( Hiđrocacbon; \(H_{2}\))
-
Theo định luật bảo toàn khối lượng:
Khối lượng ankan ban đầu = khối lượng hỗn hợp sau phản ứng .
\(\Leftrightarrow m_{x}= m_{y}\)
\(n_{H_{2}}= n_{x}= n_{y}\)
-
Công thức tính nhanh hiệu suất của phản ứng tách.
H% = (Mx/My -1).100%
-
Phương trình tổng quát:
\(C_{n}H_{2n+2} + kH_{2} \rightarrow C_{n}H_{2n+2}\)
\(C_{n}H_{2n+2-2k} + kBr_{2} \rightarrow C_{n}H_{2n+2-2k}Br_{2k}\)
-
Số mol \(H_{2}\) và số mol \(Br_{2}\) phản ứng bằng số mol liên kết \(\pi\) (Anken/ankin/ankađien)
\(n_{\pi } = n_{Br_{2}\, pu} = n_{H_{2}\, pu}\)
-
Theo định luật bảo toàn khối lượng
Khối lượng trước phản ứng = khối lượng sau phản ứng
-
Số mol hỗn hợp giảm bằng số mol \(H_{2}\) tham gia phản ứng
\(n_{hh\, truoc} – n_{hh\, sau} = n_{H_{2}\, pu}\)
Khối lượng bình brom tăng = khối lượng anken/ankin/ankađien
Bài tập về phản ứng của ankin có liên kết ba đầu mạch với dung dịch \(AgNO_{3}/NH_{3}\)
\(R-C\equiv CH + AgNO_{3} + NH_{3} \rightarrow R-C\equiv CAg^{+} NH_{4}NO_{3} (R\neq H)\)
Số mol ankin = số mol kết tủa
Khối lượng kết tủa = \(m_{ankin} + 107n_{Ag^{+}}\)
Hay: \(n_{Ag^{+}} = \frac{m_{ket\, tua} – m_{ankin}}{107}\)

Lý thuyết các công thức hóa học lớp 11 học kì 2
Trong học kỳ 2, các kiến thức về hóa hữu cơ cũng vô cùng quan trọng, yêu cầu học sinh nắm chắc phần kiến thức này. Chính công thức hóa 11 học kì 2 sẽ là nền tảng cơ bản giúp các em tiếp thu chương trình lớp 12. Sẽ có bản update mới nhất giúp bạn nắm vững các công thức hóa 11 học kì 2.
Xem thêm:
Rate this post
Please follow and like us:


Luyện tập Công thức phân tử- CTCT. Đồng đẳng- đồng phân – Thầy giáo Phạm Thanh Tùng
Bài giảng giúp các em hệ thống lại kiến thức về công thức cấu tạo, công thức phân tử, đồng đẳng đồng phân với những bài tập minh họa cụ thể dễ hiểu.
Học trực tuyến tại: http://tuyensinh247.com
Fanpage: https://fb.com/luyenthi.tuyensinh247/
Học trực tuyến tại: http://tuyensinh247.com
Fanpage: https://fb.com/luyenthi.tuyensinh247/
Học trực tuyến tại: http://tuyensinh247.com
Fanpage: https://fb.com/luyenthi.tuyensinh247/



