Tính chất hóa học của h2so4 đặc nóng, tính chất hóa học của axit sunfuric đặc
Xin chào đọc giả. , tôi xin góp chút kinh nghiệm cá nhân về mẹo vặt, kinh nghiệm không thể thiếu trong đời sống với nội dung Kim Loại Tác Dụng Với H2So4 Đặc Nóng, Tính Chất Hóa Học Của H2So4 Đặc Như Thế Nào
Phần lớn nguồn đều được lấy ý tưởng từ những nguồn trang web lớn khác nên chắc chắn có vài phần khó hiểu.
You watching: Tính chất hóa học của h2so4 đặc nóng
Mong mọi cá nhân thông cảm, xin nhận góp ý và gạch đá dưới phản hồi
Mong bạn đọc đọc bài viết này ở nơi không có tiếng ồn cá nhân để có hiệu quả nhất Tránh xa tất cả những dòng thiết bị gây xao nhoãng trong các công việc tập kết Bookmark lại bài viết vì mình sẽ cập nhật liên tục
Axit sunfuric (H2SO4) là một hóa chất hàng đầu được sử dụng trong nhiều ngành sản xuất. Vậy điện tích hóa học của H2SO4 là gì? Sự khác nhau giữa axit H2SO4 đặc và loãng là gì? Cùng tìm hiểu chi tiết qua bài viết dưới đây nhé!
Axit sunfuric là gì?
Axit sunfuric là một hóa chất lỏng giống dầu, không màu, không mùi, không bay hơi, nặng gấp đôi nước. Là một Axit vô cơ mạnh và khả năng hòa tan hoàn toàn trong nước theo bất kỳ tỷ lệ nào.
Bạn đang xem: Kim loại phản ứng với h2so4 đặc nóng
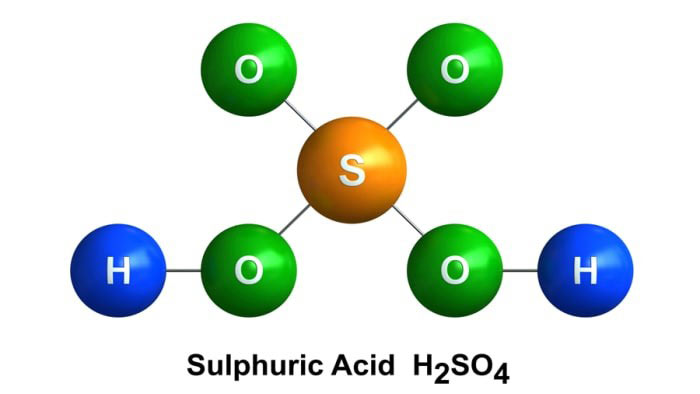
Axit sunfuric
Không thể tìm thấy H2SO4 tinh khiết trên Trái đất, do áp suất lớn giữa Axit sunfuric và nước. Ngoài ra, axit sunfuric là một thành phần của mưa axit, được hình thành từ lưu huỳnh điôxít trong nước bị oxy hóa, hoặc axit sunfuric bị oxy hóa.
Công thức phân tử: H2SO4
Tính chất hóa học của Axit sunfuric (H2SO4):
Tính chất chung của Axit sunfuric:
H2SO4 có những tính chất hóa học chung của Axit gồm:
Axit mạnh có tính ion hóa cao. Axit sulfuric có tính ăn mòn cao, dễ phản ứng và hòa tan trong nước. Nó có khả năng oxy hóa rất cao và do đó hoạt động như một chất oxy hóa mạnh. H2SO4 có độ bay hơi rất thấp. Đó là lý do mà nó góp phần điều chế các axit dễ bay hơi hơn từ các muối axit khác. H2SO4 đặc là một chất khử nước rất mạnh. Nhờ tính chất này, nó được dùng để làm khô nhiều chất khí không phản ứng với axit. Nó có khả năng khử nước các chất hữu cơ như tinh bột. Nó có thể oxy hóa cả phi kim loại cũng như kim loại.
Tính chất hóa học của H2SO4 đặc:
* Số oxi hoá mà lưu huỳnh (S) có thể có là: -2; 0; +4; +6. Trong H2SO4, S có số oxi hóa +6 cao nhất nên → H2SO4 đặc có tính axit mạnh, có tính oxi hóa mạnh và ưa nước.

Tính chất chung của Axit sunfuric
a) Axit sunfuric đặc phản ứng với kim loại
– Thí nghiệm: Cho một mẩu Cu vào ống nghiệm đựng H2SO4 đặc.
– Hiện tượng: dung dịch chuyển sang màu xanh lam và có khí bay ra, mùi xốc.
See more: Cách Diệt Nhện Trên Trần Nhà, 10 Cách Diệt Nhện Hiệu Quả Trong Nhà Dễ Thực Hiện
– Phương trình hóa học:
2H2SO4 + Cu → CuSO4 + SO2 ↑ + 2H2O
– H2SO4 đặc, nóng phản ứng với các kim loại khác
2Fe + 6H2SO4 → Fe2 (SO4) 3 + 3SO2 ↑ + 6H2O
5H2SO4 + 4Zn → 4ZnSO4 + H2S ↑ + 4H2O
* Ghi chú:
– Trong các bài thực hành, kim loại nào phản ứng với axit sunfuric đặc thường gặp nhất là tạo khí SO2, khi giải phải dùng e và bảo toàn nguyên tố:
ne = nmetal. (hóa trị) kim loại = 2nSO2nH2SO4 phản ứng = 2nSO2mm muối = mmetal + 96nSO2
– H2SO4 đặc nguội thụ động (không phản ứng) với Al, Fe và Cr.
– H2SO4 đặc phản ứng được với hầu hết các kim loại (trừ Au và Pt) → muối (trong đó kim loại có hoá trị cao) + H2O + SO2 ↑ (S, H2S).
– Tích số khử của S + 6 phụ thuộc vào độ bền của kim loại: kim loại càng mạnh thì S + 6 càng bị khử về trạng thái oxi hóa càng thấp.
b) Axit sunfuric đặc phản ứng với phi kim → oxit phi kim + H2O + SO2 ↑
– PTPƯ: H2SO4 đặc + Phi kim → Oxit phi kim + H2O + SO2 ↑
S + 2H2SO4 3SO2 ↑ + 2H2O
C + 2H2SO4 đặc CO2 + 2H2O + 2SO2 ↑
2P + 5H2SO4 → 2H3PO4 + 5SO2 ↑ + 2H2O
c) Axit sunfuric đặc phản ứng với các chất khử khác
– PTPƯ: H2SO4 đặc + chất khử (FeO, FeSO4) → Muối + H2O + SO2 ↑
2H2SO4 + 2FeSO4 → Fe2 (SO4) 3 + SO2 ↑ + 2H2O
2FeO + 4H2SO4 → Fe2 (SO4) 3 + SO2 ↑ + 4H2O
d) Tính ưa nước của axit sunfuric
– Thí nghiệm: Cho H2SO4 đặc vào cốc đựng đường
– Hiện tượng: Đường chuyển sang màu đen và sôi
– Phương trình hóa học:
C12H22O11 + H2SO4 → 12C + H2SO4 .11H2O
Tính chất hóa học Axit sunfuric loãng:
H2SO4 loãng là một axit mạnh, có tất cả các tính chất hóa học chung của các axit: a) Axit sunfuric loãng làm xanh quỳ tím đỏ.
b) Axit sunfuric không phản ứng với kim loại trước H (trừ Pb) → muối sunfat (trong đó kim loại có hóa trị thấp) + H2 ↑
– PTFE: H2SO4 loãng + Kim loại → Muối + H2 ↑
Ví dụ: Fe + H2SO4 → FeSO4 + H2 ↑
Mg + H2SO4 → MgSO4 + H2 ↑
* Ghi chú:
nH2 = nH2SO4msalt = mmetal + mH2SO4 – mH2 = mmetal + 96nH2c) Axit sunfuric loãng phản ứng với oxit bazơ → muối (trong đó kim loại vẫn hóa trị) + H2O
– PTPƯ: H2SO4 loãng + Oxit bazơ → Muối + H2O
Ví dụ: FeO + H2SO4 → FeSO4 + H2O
MgO + H2SO4 → MgSO4 + H2O
* Ghi chú:
nH2SO4 = nH2O = nO (trong oxit) mmsalt = moxit + mH2SO4 – mH2O = moxit + 98nH2SO4 – 18nH2O = moxit + 80nH2SO4 = moxit + 80n (O trong oxit) d) Axit sunfuric loãng phản ứng với bazơ → muối + H2O
– PTPƯ: H2SO4 loãng + Bazơ → Muối + H2O
Ví dụ: H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
– Phản ứng của H2SO4 với Ba (OH) 2 hoặc bazơ tạo kết tủa chỉ tạo thành muối sunfat.
See more: Sửa Lỗi Print Spooler Win 7, Lỗi Print Spooler Của Máy In
Ví dụ: Cu (OH) 2 + H2SO4 → CuSO4 ↓ + 2H2O
Ba (OH) 2 + H2SO4 → BaSO4 ↓ + 2H2O
e) Axit sunfuric loãng phản ứng với muối → muối mới (trong đó kim loại vẫn hóa trị) + axit mới
– PTPƯ: H2SO4 loãng + Muối → Muối mới + Axit mới
Ví dụ: Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
* Lưu ý: Phương pháp tăng giảm khối lượng thường dùng khi giải các bài tập về phản ứng của axit sunfuric với muối.
Phương pháp điều chế H2SO4:
– FeS2 hoặc S → SO2 → SO3 → H2SO4
Đốt quặng sắt firit:
4FeS2 + 11O2 → 8SO2 + 2Fe2O3
Oxi hoá SO2 bằng oxi ở điều kiện 400 – 5000C, xúc tác V2O5:
2SO2 + O2 → 8SO3
Axit sunfuric đặc hấp thụ SO3 tạo thành oleum có công thức chung là H2SO4.nSO3:
Kim loại Al, Zn, Cu tác dụng với H2SO4 đặc nguội và đặc nóng ? Mr. Skeleton Thí Nghiệm
► Hãy bấm đăng ký kênh nếu bạn thấy video hay và bổ ích nhé ! Thanks
© Bản quyền thuộc về Mr.Skeleton Thí Nghiệm
© Copyright by Mr.Skeleton Thí Nghiệm
Experiment ThiNghiemhoahoc MrSkeleton
CoolScience
khamphathegioi khamphavutru